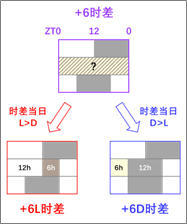
光是影响生物节律最重要的环境因子,通过改变光照时间来模拟时差,是生物钟领域最常用的诱导昼夜紊乱的手段。然而,传统研究主要关注的时差方向和大小(如+6时差可代表开关灯时间提前6小时)只能明确时差前后的昼夜时间,并不能明确时差设定当天的具体程序,而不同程序对机体的影响是否存在差异,尚不清楚。这个容易被忽略的细节变化可能会给实验结果(如对时差适应性的评估)带来一定的不确定性,这是生物钟领域非常基础却从未被触及的重要问题。
2024年10月14日,生物钟基础与应用团队负责人杨光锐教授与华东师范大学陈丽红教授团队合作,在生物钟专业期刊Journal of Pineal Research(中科院1区)发表题为“Differential Effects of Light and Dark Phase Modifications on Jet Lag Adaptability in Mice”的成果,对上述问题进行了深入探讨。研究首次提出“L型时差”与“D型时差”的概念,分别代表时差当天昼长夜短及昼短夜长的两种程序(常见的时差程序均存在昼夜不等长的情形),并提出了缓解生物钟紊乱的新策略。联合培养博士生马常啸为论文的第一作者,杨光锐教授与陈丽红教授为论文的共同通讯作者。

该研究首先对小鼠进行L/D两种类型的12小时时差(12L vs. 12D)及±6时差(+6L vs. +6D, -6L vs. -6D)处理。结果显示,L型时差处理的小鼠在行为节律和体温节律的调整速度上明显快于D型时差处理组;通过对时差敏感的败血症模型小鼠进行研究,发现L型时差处理的小鼠展现出更好的健康状况。随后,研究人员对+8,9,10,11时差进行了更广泛的探索,进一步明确了小鼠更易于适应L型时差的处理。在机制研究中,发现L型时差延长了小鼠的睡眠时间,这可能是加快其适应速度及减轻健康损害的关键。当通过睡眠剥夺实验消除L型与D型时差小鼠睡眠时长的差异后,两组小鼠在适应性和健康方面的差异也随之消失,进一步证明了睡眠在缓解生物钟紊乱中的重要作用。
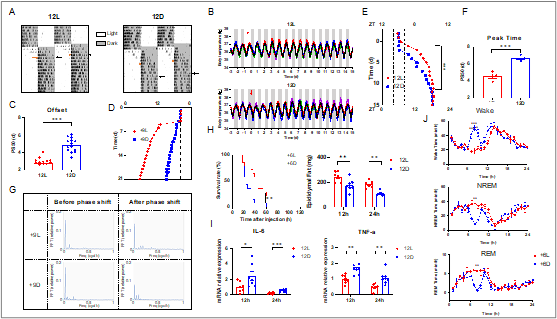
这项工作不仅为理解昼夜节律的适应机制提供了新的理论支持,还提出了通过光照与睡眠管理缓解时差问题的非药物干预新思路。此外,当前生物钟领域中,人工时差模型在灯光程序设定上缺乏统一的标准,本研究通过引入“L/D型时差”这一新概念,强调了光照设定程序的多样性对实验结果的显著影响,为时差研究的规范化提供了重要的理论基础。
这是该合作团队继今年5月在同名杂志发表关于生物钟紊乱与慢性肾脏疾病发生发展关系的成果“Circadian light/dark cycle reversal exacerbates the progression of chronic kidney disease in mice”后的另一项重要发现。

上述研究得到了国家自然科学基金和科技部重点研发计划重点专项的基金支持。
